Oxit Axit Là Gì? Định Nghĩa, Tính Chất Đặc Trưng
Oxit axit là cái tên không thể quen thuộc hơn đối với học sinh phổ thông trong bộ môn hoá học. Nhưng không phải ai cũng nhớ được các tính chất và sự đặc trưng của nó. Hôm nay chúng ta cùng tìm hiểu oxit axit là gì cũng như những điều liên quan đến chất hoá học này.
- Nước cứng là gì? Hướng dẫn giải pháp xử lý hiệu quả?
- Phễu Chiết Là Gì? Cấu Tạo Và Công Dụng Của Phễu Chiết
- PPM Là Gì? Tác Dụng, Cách Dùng Và Cách Chuyển Đổi
Menu
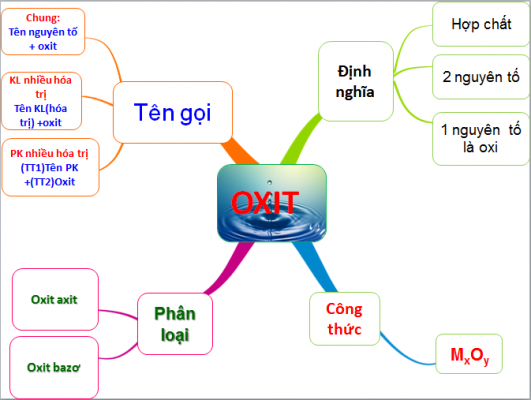
Oxit Axit là gì?
Khái quát về oxit axit
Oxit axit còn được gọi là anhidrit axit, đây là các loại oxit có tác dụng với bazơ để tạo thành muối hóa học và tác dụng với nước để tạo thành axit.
Oxit axit thường là của phi kim nên khi chúng tác dụng được với nước sẽ tạo ra các sản phẩm axit tương ứng. Oxit axit sẽ bao gồm hai nguyên tố hóa học, trong đó sẽ có một nguyên tố là oxi.
Công thức tổng quát của oxit axit là: MxOy.
Cách gọi tên oxit axit như sau: tên tiền tố chỉ số nguyên tử của phi kim + tên của phi kim + tên tiền tố chỉ số của nguyên tử oxi + ‘‘oxit’’
Như vậy chúng ta vừa đi tìm hiểu khái quát về định nghĩa oxit axit là gì và biết cách gọi tên các oxit axit sao cho chính xác nhất.
Oxit bao gồm những loại nào?

Các oxit axit
Ở trên là định nghĩa về oxit axit là gì vậy oxit gồm có những loại nào chúng ta cùng tìm hiểu ngay dưới đây:
Oxit bazơ
Đây là loại oxit chúng có thể tác dụng được với axit để tạo ra sản phẩm gồm muối và nước. Ngoài ra một số oxit bazơ phản ứng được với H2O để tạo thành bazơ tan gọi là dung dịch kiềm.
Ví dụ một số chất như: Na2O – NaOH, Fe2O3 – Fe(OH)3…
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Oxit axit
oxit axit là gì – Oxit axit là các loại oxit khi tác dụng với H2O sẽ tạo ra axit, tác dụng với kiềm sẽ tạo ra muối hóa học. Oxit axit thường là oxit của phi kim ứng với một axit hoặc một kim loại có hóa trị cao.
Nghĩa là những oxit tác dụng với bazơ sẽ tạo ra muối và nước, phản ứng với nước tạo sẽ axit.
Ví dụ như: Mn2O7 → HMnO4, CO2 → H2CO3, P2O5 → H3PO4.
P2O5 + 3H2O → 2H3PO4
Các oxit lưỡng tính
Là loại oxit mà chúng có thể tác dụng được với cả axit hoặc bazơ để ra muối và nước.
Ví dụ: Al2O3 và ZnO.
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Oxit trung tính
Đây là các oxit không phản ứng với H2O để tạo ra bazơ hay axit, không phản ứng với bazơ hay axit để tạo ra muối.
Ví dụ: CO (hay cacbon monoxit) và NO (hay nitơ monoxit),…
Trên đây là những loại oxit mà chúng ta đã tìm hiểu trong chủ đề oxit axit là gì.
Tính chất hóa học của các oxit axit như thế nào?

Tính chất hoá học của oxit axit
Để hiểu rõ hơn oxit axit là gì và đã là một chất hoá học thì nhất định không thể thiếu các tính chất hoá học đặc trưng riêng của mình.
Oxit axit có thể tan trong nước (tác dụng với H2O)
Trừ SiO2 thì hầu hết các oxit axit đều tan được trong nước và tạo thành dung dịch axit.
Ví dụ:
CO2 + H2O ⇌ H2CO3
P2O5 + 3H2O ⇌ 2H3PO4
Mn2O7 + H2O ⇌ 2HMnO4
SO2 + H2O ⇌ H2SO3
Các phản ứng này còn được gọi là phản ứng thuận nghịch.
Oxit axit tác dụng với oxit bazơ tan để tạo ra muối
Thông thường đó là các oxit có thể tác dụng được với nước (như Na2O, CaO, K2O hay BaO)
Ví dụ:
Na2O + CO2 -> Na2CO3
P2O5 + 3K2O -> 2K3PO4
Tác dụng với các bazơ tan
Lưu huỳnh đioxit
Bazơ tan là các bazơ của kim loại kiềm và kiềm thổ. Cụ thể là 4 bazơ tan sau: NaOH, Ca(OH)2, KOH, Ba(OH)2.
SO2 + Ba(OH)2 → BaSO4 + H2O
Tuỳ vào tỉ lệ mol giữa oxit axit và bazơ tan tham gia phản ứng mà sản phẩm tạo ra sẽ khác nhau, có thể là nước + muối trung hòa, có thể là muối axit hoặc hỗn hợp 2 muối.
Thứ nhất: gốc axit có hóa trị I
Đối với các kim loại trong bazơ có hoá trị I:
Với tỉ lệ mol giữa bazơ và oxit axit là 1: phản ứng sẽ tạo ra muối axit
- VD: KOH + SO2→ KHSO3
Với tỉ lệ mol bazơ và oxit axit là 2: phản ứng tạo ra muối trung hoà
- VD: 2NaOH + SO3 → Na2SO3 + H2O
Đối với các kim loại trong bazơ có hoá trị II:
Với tỉ lệ mol bazơ và oxit axit là 1: phản ứng tạo muối trung hoà
- VD: CO2 + Ca(OH)2 → CaCO3
Tỉ lệ mol bazơ và oxit axit là 2: phản ứng tạo ra muối axit
- VD: SiO2 + Ba(OH)2 → BaSiO3
Đối với các axit có gốc axit hoá trị III:
Đối với các kim loại có hoá trị I:
Với tỉ lệ mol bazơ và oxit axit là 6:
- VD: P2O5 + 6NaOH → 2Na2HPO4 +H2O
Với tỉ lệ mol bazơ và oxit axit là 4:
P2O5 + 4NaOH → 2NaH2PO4 +H2O
Với tỉ lệ mol bazơ và oxit axit là 2:
P2O5 + 2NaOH +H2O → 2NaH2PO4
Đó là 3 tính chất đặc trưng của oxit axit, qua những tính chất này mong rằng bạn sẽ hiểu hơn về oxit axit là gì và cảm thấy thú vị.
Các bước để giải bài tập về oxit axit

Oxit axit và thực hành
Chúng ta đã hiểu khái quát oxit axit là gì vậy dưới đây là các bước giúp bạn giải bài tập về oxit axit dễ dàng hơn:
Dạng bài 1: Cho oxit axit X tác dụng với dung dịch kiềm (như NaOh, Ba(OH)2…)
PTPƯ:
CO2 + KOH → K2CO3 + H2O (1)
CO2 + KOH → KHCO3 (2)
Cách giải:
Bước 1: xét tỷ lệ mol của bazơ và oxit axit (gọi là T)
- Nếu T ≥ 2 thì ta thu được sản phẩm là muối trung hòa thì xảy ra phản ứng (1)
- Nếu 1 < T < 2: thu được cả muối axit và muối trung hoà thì xảy ra cả 2 phản ứng (1) và (2)
- Nếu T ≤ 1: thu được muối axit thì chỉ xảy ra phản ứng (2)
Bước 2: Viết phương trình phản ứng hóa học.
Bước 3: Từ PTHH ta áp dụng định luật bảo toàn khối lượng và bảo toàn nguyên tố để giải bài tập.
Dạng bài 2: cho oxit axit tác dụng với dung dịch kiềm thổ (NaOH, Ca(OH)2, KOH, Ba(OH)2)
Với dạng này ta áp dụng các bước giải như ở dạng 1.
Đó là 2 dạng bài cơ bản thường gặp trong chủ đề oxit axit là gì các bạn có thể tham khảo và làm theo các bước để thu được kết quả tốt nhất.
Tổng kết
Như vậy chúng ta vừa tìm hiểu các thông tin xoay quanh oxit axit là gì. Hy vọng qua bài viết này các bạn có được những kiến thức và thông tin bổ ích hơn về hoá học đặc biệt là chủ đề oxit axit là gì đồng thời cảm thấy yêu hoá học hơn.
Để biết thêm nhiều thông tin, kiến thức bổ ích và thú vị về khoa học và cuộc sống các bạn hãy truy cập vào ngay website nuoccat.vn.

